化学平衡移动?
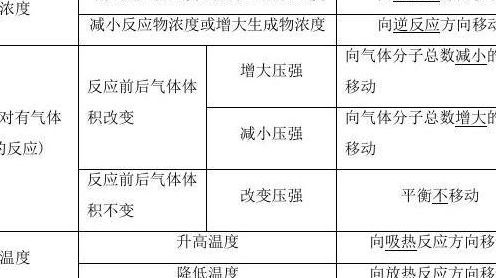
1、影响平衡移动的因素只有有浓度、压强和温度三个。 浓度对化学平衡的影响 在其他条件不变时,增大反应物浓度或减小生成物浓度, 平衡向正反应方向移动;减小反应物浓度或增大生成物浓度, 平衡向逆反应方向移动。
2、如果各组分都是气体的话,恒容下增大压强和充入反应物平衡右移。恒压下加入反应物平衡右移。恒容下增大压强的方法有充入惰性气体(或与该反应无关的气体)和增加反应物或者生成物。
3、减小压强 平衡向气体体积增大的方向移动 。可以理解为向气体体积大的方向移动。4>2,反应物总体积大于生成物总体积,所以平衡左移。
化学平衡移动的规律是什么?
1、当△Ho,△S0,因为T0,所以在低温的时候△G0,反应是非自发进行的,在高温时△G0,反应是自发进行的。请采纳。
2、压强 压强升高,反应向气体计量系数变小的一方移动;压强降低,向气体计量系数变大的方向移动。
3、其它条件不变,增加某种反应物的浓度时,正反应的即时速度增大,逆反应的即时速度不变,使得正反应速度大于逆反应速度,平衡正向移动。
4、在CO(g) + H2O(g) CO2(g) + H2(g)反应中,增加压力会使平衡向反应物CO和H2O方向移动,因为CO和H2O分子数比CO2和H2分子数多。
化学平衡发生移动的标志是什么发生变化?
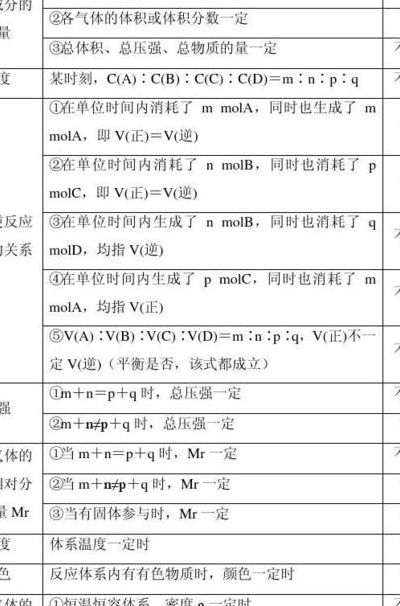
1、化学平衡发生移动的标志是反应混合物各组分的百分含量发生变化。主要因素:浓度、温度、压强。
2、化学平衡状态的标志是:正逆反应速率相等,各组分的含量不再发生变化。而化学平衡发生移动的标志应该是化学平衡状态发生变化,即各组分的百分含量发生变化。
3、化学平衡的标志是:①;②各组分的物质的量、质量、含量保持不变。速度与平衡的关系 ,平衡向正反应方向移动。,平衡不移动。,平衡向逆反应方向移动。化学平衡状态的特征 逆:研究对象是可逆反应。
4、化学平衡移动的条件只有温度 浓度 压强,而催化剂只是提高了活化分子在体系中的百分比,只是改变了化学反应的速率,且改变速率不是单向的,而是既增大了正反应速率又增大了逆反应速率,所以宏观表现上平衡不移动。
5、变:化学平衡跟所有的动态平衡一样,是有条件的,暂时的,相对的,当条件发生变化时,平衡状态就会被破坏,由平衡变为不平衡,再在新的条件下建立新平衡,即化学平衡发生了移动。
文章声明:以上内容(如有图片或视频亦包括在内)除非注明,否则均为网友提供,转载或复制请以超链接形式并注明出处。