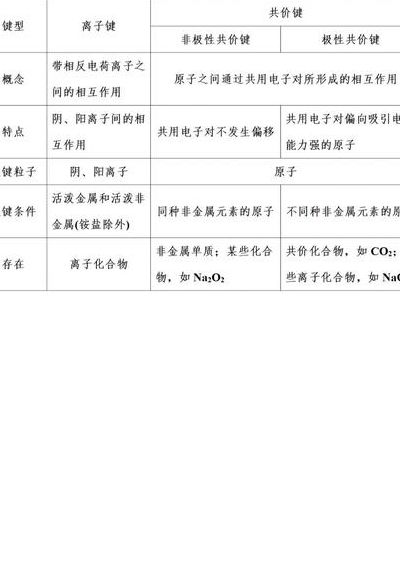
共价化合物和离子化合物的区别
共价化合物和离子化合物的区别具体如下:熔点和沸点不同离子化合物一般说来,熔点和沸点较高,硬度较大,质脆,难于压缩,难挥发。共价化合物多数共价化合物在固态时,熔点、沸点较低,硬度较小。导电性不同离子化合物都是电解质,且在水溶液和熔融状态下都可以导电。
离子化合物和共价化合物的差异主要体现在熔点、沸点、导电性以及熔化时破坏的作用力等方面。 熔点和沸点的差异:离子化合物通常具有较高的熔点和沸点,硬度较大,质地较脆,不易压缩,也不易挥发。相比之下,共价化合物在固态时的熔点和沸点通常较低,硬度也较小。
共价化合物:是原子间以共用电子对所组成的化合物分子。例如,氯化氢是氢原子和氯原子各以最外层一个电子形成一个共用电子对而组成的化合物分子。根据化合物的类型来判断 离子化合物:强碱、大多数的盐(包括铵盐)和大部分金属氧化物都是离子化合物。
什么叫离子化合物?
离子化合物是由正离子和负离子通过离子键结合而形成的化合物。在离子化合物中,正离子是带正电荷的原子或原子团,负离子是带负电荷的原子或原子团。离子化合物通常由金属元素和非金属元素组成。金属元素倾向于失去电子变成正离子,而非金属元素倾向于获得电子变成负离子。
离子化合物是由带正电荷的阳离子和带负电荷的阴离子通过静电作用结合而成的化合物。在高中阶段,我们可以通过以下方法来判断一种化合物是否为离子化合物: 判断离子化合物的直接方法:在熔融状态下,如果化合物能导电,则它是离子化合物;如果不能导电,则是共价化合物。
离子化合物,是由阴离子(Anion,带负电)和阳离子(Cation,带正电)组成,以本质上是库仑力的离子键相结合的化合物。离子化合物通常熔点和沸点较高,熔融时或电离产生其组成离子的水溶液中时能导电。
硫酸是不是离子化合物
1、硫酸是共价化合物,不是离子化合物。纯净的硫酸由H2SO4分子组成,分子间都是共价键,没有离子键。在稀的硫酸水溶液中,由于水分子的作用,硫酸分子几乎完全电离成为水合离子:H2SO4=2H+ +HSO4-(实际上是分步电离;第二步电离度约30%,但中学范围内当作完全电离)。
2、所以硫酸是共价化合物!相信我,记住我说的方法!H2SO4是共价化合物,由分子构成! 因为硫酸在熔化状态下不导电,离子化合物的导电是因为本身有离子,只是在固态时不能自由移动;而共价化合物本身没有离子,只有分子,如:硫酸,它的溶液导电是因为水分子的影响下电离的。
3、不是,是共价化合物,离子化合物包括强碱,大多数盐类,活泼金属的氧化物及过氧化物。
4、是由硫和氧通过共价键结合形成的,其分子中不含活泼金属原子或铵根离子,因此不符合离子化合物的定义。硫酸是一种无机化合物,化学式是H2SO4,是硫的最重要的含氧酸。纯净的硫酸为无色油状液体,36℃时结晶,通常使用的是它的各种不同浓度的水溶液,用塔式法和接触法制取。
离子化合物的定义
1、离子化合物是由阳离子和阴离子通过离子键结合而成的化合物。 在固态下,这些离子之间通过强烈的离子键相互作用,形成稳定的晶体结构。 随着温度的升高,离子之间的振动幅度增大,导致离子晶体在达到熔点时熔化成为液态,此时离子可以自由移动,因此离子化合物在熔融状态下可以导电。
2、离子化合物是由正负电荷的离子通过电磁作用相互结合而形成的化合物。离子化合物中,阳离子是带有正电荷的金属或非金属离子,阴离子是带有负电荷的非金属离子。离子化合物具有晶体结构,高熔点和导电性等特点。
3、离子化合物是由带正电荷的阳离子和带负电荷的阴离子通过静电作用结合而成的化合物。在高中阶段,我们可以通过以下方法来判断一种化合物是否为离子化合物: 判断离子化合物的直接方法:在熔融状态下,如果化合物能导电,则它是离子化合物;如果不能导电,则是共价化合物。
4、离子化合物是由正离子和负离子通过离子键结合而形成的化合物。在离子化合物中,正离子是带正电荷的原子或原子团,负离子是带负电荷的原子或原子团。离子化合物通常由金属元素和非金属元素组成。金属元素倾向于失去电子变成正离子,而非金属元素倾向于获得电子变成负离子。
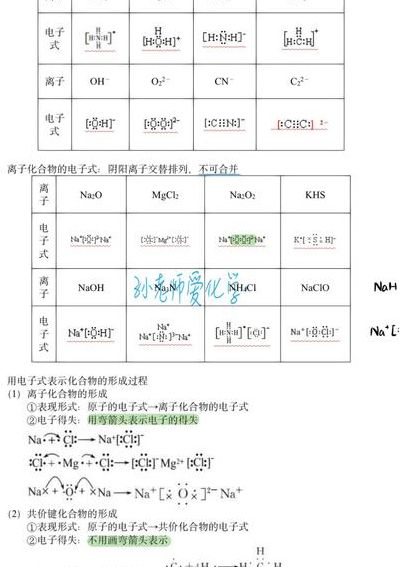
5、定义:1)离子化合物是由阴、阳离子相互作用而构成的化合物叫离子化合物 2)共价化合物是不同元素的原子间以共用电子对形成分子的化合物 叫共价化合物 关系:共价化合物发生在非金属原子之间而离子化合物却发生在典型的非金属原子与典型的金属原子之间。
什么是离子化合物
1、离子化合物是由正离子和负离子通过离子键结合而形成的化合物。在离子化合物中,正离子是带正电荷的原子或原子团,负离子是带负电荷的原子或原子团。离子化合物通常由金属元素和非金属元素组成。金属元素倾向于失去电子变成正离子,而非金属元素倾向于获得电子变成负离子。
2、离子化合物是由带正电荷的阳离子和带负电荷的阴离子通过静电作用结合而成的化合物。在高中阶段,我们可以通过以下方法来判断一种化合物是否为离子化合物: 判断离子化合物的直接方法:在熔融状态下,如果化合物能导电,则它是离子化合物;如果不能导电,则是共价化合物。
3、离子化合物是由阳离子和阴离子通过离子键结合而成的化合物。 在固态下,这些离子之间通过强烈的离子键相互作用,形成稳定的晶体结构。 随着温度的升高,离子之间的振动幅度增大,导致离子晶体在达到熔点时熔化成为液态,此时离子可以自由移动,因此离子化合物在熔融状态下可以导电。
什么是离子化合物?
1、离子化合物是由正离子和负离子通过离子键结合而形成的化合物。在离子化合物中,正离子是带正电荷的原子或原子团,负离子是带负电荷的原子或原子团。离子化合物通常由金属元素和非金属元素组成。金属元素倾向于失去电子变成正离子,而非金属元素倾向于获得电子变成负离子。
2、离子化合物,是由阴离子(Anion,带负电)和阳离子(Cation,带正电)组成,以本质上是库仑力的离子键相结合的化合物。离子化合物通常熔点和沸点较高,熔融时或电离产生其组成离子的水溶液中时能导电。
3、离子化合物是由阴离子和阳离子通过静电吸引力结合而成的化合物。例如,氧化钠(Na2O)、氧化钾(K2O)、氯化钠(NaCl)、氟化钾(KF)以及氢氧化钠(NaOH)等都是典型的离子化合物。它们在熔融状态下或在水溶液中能够导电,这是因为阴、阳离子可以在溶液中自由移动。
文章声明:以上内容(如有图片或视频亦包括在内)除非注明,否则均为网友提供,转载或复制请以超链接形式并注明出处。