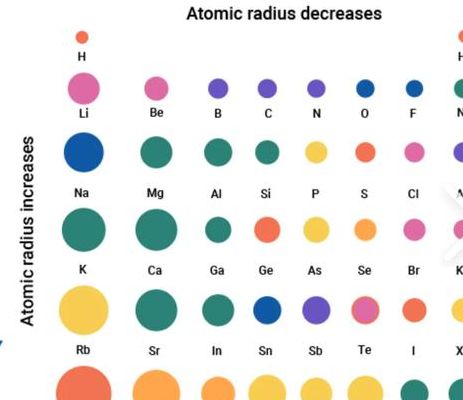
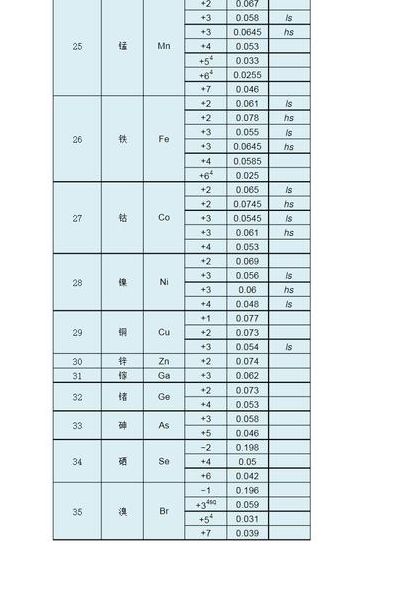
...提供元素周期表中所有元素原子半径和简单离子半径的数值
1、硅(台湾、香港称矽xī)是一种化学元素,它的化学符号是Si,旧称矽。原子序数14,相对原子质量20855,有无定形硅和晶体硅两种同素异形体,属于元素周期表上第三周期,IVA族的类金属元素。
2、原子半径表:http://wenku.baidu.com/view/1c2cf1aad1f34693daef3echtml,简单离子半径表:http://wenku.baidu.com/view/ece6734e852458fb770b563html。通过这些数据,我们可以深入了解不同元素的特性,这对于学习和研究化学学科具有重要意义。
3、离子半径:正离子半径通常比对应的原子半径要小,而负离子半径则通常比原子半径要大。这是因为正离子失去了外层电子而电子云收缩,而负离子获得了额外的电子而电子云扩展。周期表内:在周期表中,原子半径从左上角到右下角逐渐增加。换句话说,同一周期内,元素的原子半径逐渐增大。
简单离子半径和离子半径有什么区别,该怎么比较
1、如Cl最外层有7个电子,最容易得1个电子,变为Cl-离子,这就是简单离子(稳定结构的离子)。当然Cl可以失电子,变为化合态离子,如+++++7价,但这些都是不稳定结构的离子,当然,失电子越多,正价越高,离子半径就越小了。
2、从高中化学角度讲简单离子半径,实际就是单个原子得失电子形成稳定结构的离子的半径,金属原子形成阳离子,非金属原子形成阴离子。在高中,离子半径的说法基本就是简单离子半径。
3、简单离子半径比较如下:同一元素的微粒,电子数越多,半径越大。如钠原子-钠离子,氯原子同一周期内元素的微粒,阴离子半径大于阳离子半径。如氧离子-锂离子。离子半径怎么比较。同类离子与原子半径比较相同。
4、顾名思义,简单离子半径就是简单离子的半径,而离子半径,就是指所有离子的半径。就简单离子而言,什么是简单离子呢,应所中学常见的主族元素的常见化合价的离子都是简单离子,像钠离子、氯离子等。
5、离子半径,这个首先要知道离子一般都是稀有气体电子外壳型的,对吧。2,2-8,2-8-8。简单离子就是这种。八个字:阴上阳下,序小径大。就是说在电子外壳型相同的情况下,阴离子在上一周期,阳离子在下一周期。比如Na+和F-。而且原子序数小的半径大,O2-的半径大于F-,Na+大于Mg2+。
简单离子半径指的是什么,所有原子都有简单离子半径吗?都唯一吗?_百度...
1、简单离子半径指的是从原子核到最外层电离的平均距离。不唯一。如Fe2+的离子半径就比Fe3+的大;H+就比H-的小。有的原子不能形成简单离子,如C等元素不会生成C4+或者C4-,只能以CO32-等离子形式存在。
2、顾名思义,简单 离子半径 就是简单离子的半径,而离子半径,就是指所有离子的半径。就简单离子而言,什么是简单离子呢,应所中学常见的 主族元素 的常见 化合价 的离子都是简单离子,像 钠离子 、氯离子 等。
3、从高中化学角度讲简单离子半径,实际就是单个原子得失电子形成稳定结构的离子的半径,金属原子形成阳离子,非金属原子形成阴离子。在高中,离子半径的说法基本就是简单离子半径。
简单离子半径比较方法
在比较离子半径时,以下方法简单有效: 观察同一元素的不同形态:阳离子的半径通常小于其原子的半径,而阴离子的半径则大于其原子的半径。例如,钠离子(Na+)的半径小于钠原子(Na),而氯离子(Cl-)的半径大于氯原子(Cl)。
简单离子半径比较方法包括以下几个方面: 对于同一元素的微粒,电子数越多,半径越大。例如,钠原子的半径小于钠离子的半径,氯原子的半径大于氯离子的半径,亚铁离子的半径大于铁离子的半径。 在同一周期内,阴离子的半径大于阳离子的半径。例如,氧离子的半径大于锂离子的半径。
简单离子半径比较如下:同一元素的微粒,电子数越多,半径越大。如钠原子-钠离子,氯原子同一周期内元素的微粒,阴离子半径大于阳离子半径。如氧离子-锂离子。离子半径怎么比较。同类离子与原子半径比较相同。
比较方法如下:电子层数:电子层数越多,离子半径越大。电子在原子核外按层排布,类似于洋葱,皮的层数越多,洋葱的半径自然就越大。核电荷数:电子层数相同,比较核电荷数,核电荷数越多,离子半径越小。
文章声明:以上内容(如有图片或视频亦包括在内)除非注明,否则均为网友提供,转载或复制请以超链接形式并注明出处。