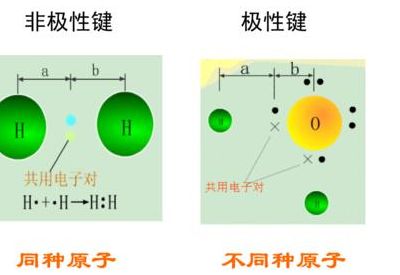
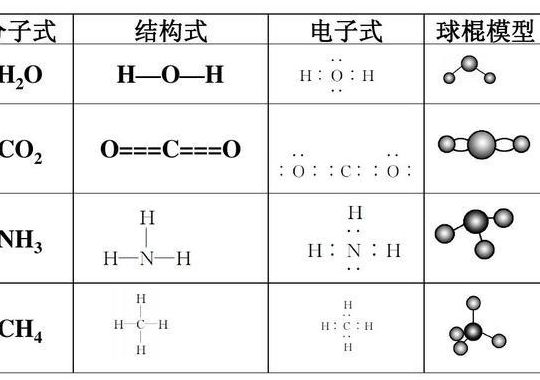
如何判断共价键
1、电负性差异法:根据元素的电负性差异来判断共价键的极性。电负性差异大于0.4的元素之间形成极性共价键,电负性差异小于0.4的元素之间形成非极性共价键。原子的价电子数:根据元素的原子结构和周期表中的位置,可以确定元素的价电子数。
2、判断共价键的方法如下:判断化学键中原子的电负性差异。如果原子的电负性相差较小,如H和C,C和O,C和N,C和S等,那么它们之间的化学键就是共价键。根据化合物的性质判断化学键类型。
3、共价键判断方法如下:根据化合物的性质判断化学键类型。如果化合物为非电解质,比如C2H6,C12等,则化学键为共价键;如果化合物为电解质,比如NaC1,MgS04等,则化学键为离子键。根据共价键的电子构型判断。
4、判断σ键和π键的一般规律是:共价单键是σ键;双键中有一个σ键和一个π键;三键中有一个σ键和两个π键。非金属元素原子之间以共用电子对形式形成的化学键叫做共价键。它具有饱和性和方向性。通过以前的学习我们知道共价键可以分为极性共价键和非极性共价键。
5、多数情况下非金属和非金属之间的键是共价键。在极性键中,非金属性相对较强的元素原子一端相对显负电性非金属性相对较弱的元素原子一端相对显正电性。在极性键中,成键元素的非金属性差别越大,共价键的极性越明显(越强); 成键元素的非金属性差别越小,共价键的极性越明显(越弱)。
如何判断一个化学反应里共价键是否存在?
1、同种原子间形成的共价键,共用电子对不偏向任何一个原子,成键原子都不显电性,这种键称为非极性键。
2、最后,共价键的类型也可以通过观察物质的化学性质和反应特征来判断。某些特定的反应可以推断出共价键的性质,如键的断裂、形成新的化合物等。例如,在水的电离过程中,水分子中的氧原子与氢原子之间的共价键被断裂,形成氢离子和氢氧根离子。这表明水分子中存在极性共价键。
3、判断化学键中原子的电负性差异。如果原子的电负性相差较小,如H和C,C和O,C和N,C和S等,那么它们之间的化学键就是共价键。根据化合物的性质判断化学键类型。如果化合物为非电解质,比如C2H6,Cl2等,则化学键为共价键;如果化合物为电解质,比如NaCl,MgSO4等,则化学键为离子键。
4、共价键是由两个原子之间共享电子对形成的,因此,可以从物质的结构来判断是否存在共价键。例如,水分子的结构是由两个氢原子和一个氧原子组成的,两个氢原子之间存在共价键,而氢原子和氧原子之间也存在共价键,因此,可以判断水分子中存在共价键。
5、判断σ键和π键的一般规律是:共价单键是σ键;双键中有一个σ键和一个π键;三键中有一个σ键和两个π键。非金属元素原子之间以共用电子对形式形成的化学键叫做共价键。它具有饱和性和方向性。通过以前的学习我们知道共价键可以分为极性共价键和非极性共价键。
6、化学变化的本质是旧键的断裂和新键的形成,化学反应中,共价键存在两种断裂方式,在化学反应尤其是有机化学中有重要影响。
如何判断共价键?
1、判断化学键中原子的电负性差异。如果原子的电负性相差较小,如H和C,C和O,C和N,C和S等,那么它们之间的化学键就是共价键。根据化合物的性质判断化学键类型。如果化合物为非电解质,比如C2H6,Cl2等,则化学键为共价键;如果化合物为电解质,比如NaCl,MgSO4等,则化学键为离子键。
2、电负性差异法:根据元素的电负性差异来判断共价键的极性。电负性差异大于0.4的元素之间形成极性共价键,电负性差异小于0.4的元素之间形成非极性共价键。原子的价电子数:根据元素的原子结构和周期表中的位置,可以确定元素的价电子数。
3、共价键判断方法如下:根据化合物的性质判断化学键类型。如果化合物为非电解质,比如C2H6,C12等,则化学键为共价键;如果化合物为电解质,比如NaC1,MgS04等,则化学键为离子键。根据共价键的电子构型判断。
4、判断σ键和π键的一般规律是:共价单键是σ键;双键中有一个σ键和一个π键;三键中有一个σ键和两个π键。非金属元素原子之间以共用电子对形式形成的化学键叫做共价键。它具有饱和性和方向性。通过以前的学习我们知道共价键可以分为极性共价键和非极性共价键。
5、多数情况下非金属和非金属之间的键是共价键。在极性键中,非金属性相对较强的元素原子一端相对显负电性非金属性相对较弱的元素原子一端相对显正电性。在极性键中,成键元素的非金属性差别越大,共价键的极性越明显(越强); 成键元素的非金属性差别越小,共价键的极性越明显(越弱)。
判断共价键和离子键的口诀表
1、判断共价键和离子键的口诀表方法如下:口诀和特殊情况:非金属元素之间,非金属元素失去电子,共用电子对偏离,形成离子键;金属元素与非金属元素之间,金属元素失去电子,形成离子键。有些化合物中既含有共价键又含有离子键,例如一些含氧酸盐、碱等。这些化合物的化学键往往比较复杂,需要具体分析。
2、多数情况下,金属和非金属间的键是离子键,非金属和非金属之间的键是共价键,离子键共价键口诀:离子键、共价键,成键元素首先看。离子通常有金属,共价键里不常见。偶尔搞点小特殊,铵根当成金属算。
3、离子键共价键口诀:离子键、共价键,成键元素首先看。离子通常有金属,共价键里不常见。偶尔搞点小特殊,铵根当成金属算。离子键:离子键通过两个或多个原子或化学集团失去或获得电子而成为离子后形成。
4、离子键共价键口诀:离子键、共价键,成键元素首先看。离子通常有金属,共价键里不常见。偶尔搞点小特殊,铵根当成金属算。共价键的实质,可以表述成两个(或多个)原子间有共用的电子对,使双方(或多方)都满足像稀有气体那样的电子全满的稳定结构(高中阶段为最外层是8电子稳定结构)。
5、可以通过实质来区分:共价键的实质,可以表述成两个(或多个)原子间有共用的电子对,使双方(或多方)都满足像稀有气体那样的电子全满的稳定结构(高中阶段为最外层是8电子稳定结构)。
6、简单判断法:化合物中带有金属的可以判断为离子键,化合物中没有金属的为共价键。
如何判断共价键和离子键。
1、离子键和共价键的判断方法如下:根据物体的材料进行区分,离子键一般是由金属离子和非金属离子组成,一般在金属材料中存在,共价键一般是由非金属离子和非金属离子组成,一般存在非金属材料中。
2、共价键和离子键的区分:明确概念 共价键是原子间通过共用电子对所形成的化学键。而离子键则是阴阳离子之间通过静电作用所形成的化学键。共价键的特性 共价键强调原子之间电子的共享。在共价键中,原子不会完全失去或获得电子,而是与其他原子共享它们的电子,形成稳定的电子对。
3、形成过程不同:离子键是原子间得、失电子而生成阴、阳离子,然后阴、阳离子通过静电作用而形成的,共价键是原子间通过共用电子对而形成的,原子间没有得失电子,形成的化合物中不存在阴阳离子。成键时方向性不同:离子键在成键时没有方向性,而共价键却有方向性。
4、离子键和共价键在成键时方向性不同 离子键在成键时没有方向性,而共价键却有方向性。离子键是阴阳离子间通过静电引力形成的化学键,一个离子在任何方向都能同样吸引带相反电荷的离子,因此离子键没有方向性。
5、离子键 离子键是由电子转移(失去电子者为阳离子,获得电子者为阴离子)形成的。即正离子和负离子之间由于静电引力所形成的化学键。离子既可以是单离子,如Na+、CL-;也可以由原子团形成;如SO4 2-,NO3-等。离子键的作用力强,无饱和性,无方向性。离子键形成的矿物总是以离子晶体的形式存在。
6、共价键和离子键的判断依据通常可以从以下几个方面入手:形成键的粒子:共价键是由原子之间通过共享电子形成的,而离子键是由正离子和负离子之间的静电作用形成的。键的强度:共价键通常比离子键更强,因为它们是由原子之间的共享电子形成的,而离子键是由静电吸引形成的。
文章声明:以上内容(如有图片或视频亦包括在内)除非注明,否则均为网友提供,转载或复制请以超链接形式并注明出处。