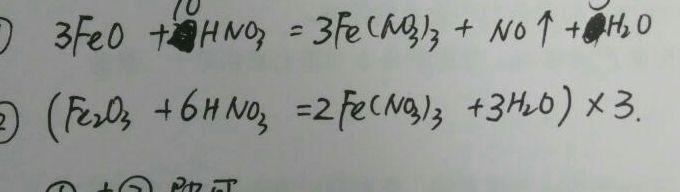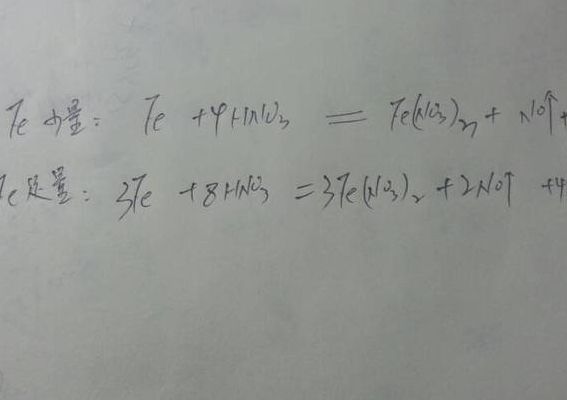fe3o4溶于稀硝酸反应方程式和离子方程式
1、反应方程式:3FeO+28HNO=9Fe(NO)+NO↑+14HO 四氧化三铁可视为FeO·FeO,溶于酸会生成2价铁离子和三价铁离子,即FeO+8H=Fe+2Fe+4HO。
2、四氧化三铁与足量稀硝酸作用生成硝酸铁、硝酸亚铁和水的反应式:Fe3O4 + 8HNO3 = 2Fe(NO3)3 + Fe(NO3)2 + 4H2O此反应属于没有电子得失的酸解反应。通常金属氧化物溶于硝酸,生成硝酸盐和水。
3、先配平化学方程式,可以采用零价法。假设取1molFeO,产物中铁为正三价,氧为-2价,铁失去电子3×3=9mol,而氧的电子2×4=8mol,因此1mol1molFeO失去1mol电子。利用得失电子守恒知硝酸得1mol电子。四氧化三铁是中学阶段唯一可以被磁化的铁化合物。
4、书写离子方程式步骤:写出化学方程式:3Fe3O4+28HNO3=9Fe(NO3)3 +NO↑+14H2O 拆:将可溶性强电解质写成离子形式,氧化物写化学式。
5、一氧化氮(浓硝酸与FeO反应生成二氧化氮)和水。因为稀硝酸有氧化性、FeO具有还原性,他们之间发生还原反应。
fe3o4与稀硝酸的反应化学方程式
1、Fe3O4+28HNO3=9Fe(NO3)3+NO↑+14H2O 解析:发生氧化还原反应,硝酸是强氧化性酸,Fe3O4中的二价铁最终被氧化生成三价铁,HNO3被还原为NO气体。
2、这个化学方程式是3Fe_3O_4+28HNO_3=9Fe(NO_3)_3+Fe(NO_3)_2+14H_2O。四氧化三铁与稀硝酸反应是一种化学反应,其中四氧化三铁(Fe3O4)与稀硝酸(HNO3)相互作用,生成硝酸铁(Fe(NO3)3)、硝酸亚铁(Fe(NO3)2)和水(H2O)。
3、Fe3O4 + 8HNO3 = 2Fe(NO3)3 + Fe(NO3)2 + 4H2O 此反应属于没有电子得失的酸解反应。通常金属氧化物溶于硝酸,生成硝酸盐和水。
四氧化三铁与稀硝酸反应的化学方程式和离子方程式
四氧化三铁与足量稀硝酸作用生成硝酸铁、硝酸亚铁和水的反应式:Fe3O4 + 8HNO3 = 2Fe(NO3)3 + Fe(NO3)2 + 4H2O此反应属于没有电子得失的酸解反应。通常金属氧化物溶于硝酸,生成硝酸盐和水。
先配平化学方程式,可以采用零价法。假设取1molFeO,产物中铁为正三价,氧为-2价,铁失去电子3×3=9mol,而氧的电子2×4=8mol,因此1mol1molFeO失去1mol电子。利用得失电子守恒知硝酸得1mol电子。四氧化三铁是中学阶段唯一可以被磁化的铁化合物。
离子方程式:3Fe3O4 + 28H+ + NO3- = 9Fe3+ + NO↑ + 14H2O 四氧化三铁和浓硝酸反应生成硝酸铁,二氧化氮和水。
写出化学方程式:3Fe3O4+28HNO3=9Fe(NO3)3 +NO↑+14H2O 拆:将可溶性强电解质写成离子形式,氧化物写化学式。
四氧化三铁也可以写成Fe2OFeO,其中Fe2O3中的Fe已经是3价的,应该不会再被氧化,所以Fe2O3的方程式为Fe2O3+6HNO3=2Fe(NO3)3+3H2O,而FeO中的Fe为2价,则还要被氧化,所以FeO的方程式为3FeO+10HNO3=3Fe(NO3)3+NO↑+5H2O。四氧化三铁溶于稀硝酸离子方程式为上述方程式加一下。
四氧化三铁与稀硝酸反应生成什么?
四氧化三铁和稀硝酸反应生成硝酸铁,一氧化氮和水。化学方程式:3Fe3O4 + 28HNO3(稀) = 9Fe(NO3)3 + NO↑ + 14H2O 离子方程式:3Fe3O4 + 28H+ + NO3- = 9Fe3+ + NO↑ + 14H2O 四氧化三铁和浓硝酸反应生成硝酸铁,二氧化氮和水。
四氧化三铁与稀硝酸反应是一种化学反应,其中四氧化三铁(Fe3O4)与稀硝酸(HNO3)相互作用,生成硝酸铁(Fe(NO3)3)、硝酸亚铁(Fe(NO3)2)和水(H2O)。在这个反应中,四氧化三铁中的铁元素被氧化为更高的价态,而硝酸则被还原为较低的价态。
四氧化三铁与足量稀硝酸作用生成硝酸铁、硝酸亚铁和水的反应式:Fe3O4 + 8HNO3 = 2Fe(NO3)3 + Fe(NO3)2 + 4H2O 此反应属于没有电子得失的酸解反应。通常金属氧化物溶于硝酸,生成硝酸盐和水。
NO3-=9Fe3+ +NO↑+14H2O 四氧化三铁是碱性氧化物,硝酸是酸,反应可以生成盐和水,但是四氧化三铁中,有一份子铁是+2价,具有还原性,硝酸具有氧化性,硝酸溶解四氧化三铁后,剩余的稀硝酸会氧化溶液中的亚铁离子,将之氧化为铁离子,硝酸被还原为一氧化氮。本反应中硝酸表现了酸性和氧化性。
文章声明:以上内容(如有图片或视频亦包括在内)除非注明,否则均为网友提供,转载或复制请以超链接形式并注明出处。